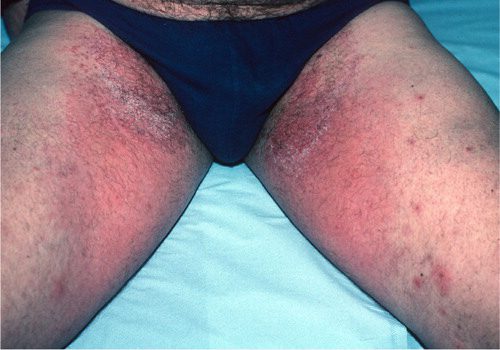
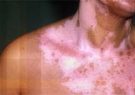
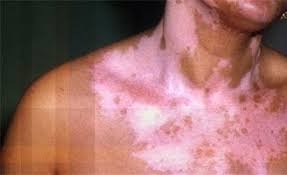
fda داروی بیولوژیک guselkumab را با نام تجاری Tremfya و محصولی از شرکت Jansse- Biotech، برای بزرگسالان مبتلا به پلاک های پسوریازیسی متوسط تا شدید، تائید کرده است.
به گزارش سایت درمانی پسوریازیس و به نقل از NBIC سازمان غذا و داروی آمریکا اعلام کرد داروی بیولوژیک guselkumab را با نام تجاری Tremfya و محصولی از شرکت Jansse- Biotech، برای بزرگسالان مبتلا به پلاک های پسوریازیسی متوسط تا شدید که کاندید درمان سیستمیک یا فوتوتراپی هستند، تائید کرده است.
داروی guselkumab:
داروی guselkumab اولین و تنها داروی بیولوژیک تائید شده است که بهطور انتخابی اینترلوکین ۲۳ را مسدود میکند. این اینترلوکین نقش کلیدی در پلاکهای پسوریازیسی بازی می کند.
آنتی بادی مونوکلونال تائید شده به صورت تزریق های زیرپوستی ۱۰۰ میلیگرمی، هر ۸ هفته یک بار، تجویز می شوند. دوزهای آغازین آن در هفته صفر و ۴ تزریق می شود.
به اعتقاد پژوهشگران، guselkumab نقطه عطف قابل توجهی در درمان پلاک های پسوریازیسی متوسط تا شدید به حساب می آید، زیرا مطالعات نشان دادهاند که اغلب بیماران تحت درمان با این درمان اختصاصی اینترلوکین ۲۳ از هفته ۱۶ تا ۴۸ درمان، به پاک شدن کامل ضایعات و پلاکها دست می یابند.
تائیدیه سازمان غذا و دارو:
تائیدیه سازمان غذا و دارو براساس نتایج ۳ مطالعه فاز ۳ با حضور بیش از ۲۰۰۰ بیمار منتشر شده است. در این مطالعات، در هفته ۱۶ درمان، حداقل ۷ بیمار از ۱۰ بیمار درمان شده با guselkumab، به PASI 90 دست یافتند و بیش از ۸۰ درصد بیماران نیز به پاک شدگی کامل یا نیمهکامل پلاک ها دست یافتند. بیمارانی که به PASI 90 در هفته ۲۸ درمان دست یافتند، تا هفته ۴۸ نیز پاسخ درمانی را حفظ کردند.
در آنالیزهای سربهسر که در هفتههای ۱۶، ۲۴ و ۴۸ درمان انجام شد، اثربخشی guselkumab توانست بر نتایج به دست آمده از adalimumab برتری پیدا کند. همچنین بیمارانی که به درمان با ustekinumab پاسخ مناسبی نداده بودند هم به درمان با guselkumab واکنش خوبی نشان دادند.






































موسوی
تاریخ : 11 - فوریه - 2020
سلام.دوستان من بطور اتفاقی که برای جلوگیری از ریختن موی سرم سولفات زینگ که یه نوع ویتامین بی ضرره خوردم بعد دو هفته کل دستان که درگیر بود کاملا خوب سده الان مشکلم پوست نیست بلکه آراست مفاصل هست . گفتم اینو با شما اشتراک بزارم حتما اونای که مشکل پوستی دارند حتما از این دارو استفاده کنند انشالله حتما نتیجه میگیرند.
میثم
تاریخ : 21 - سپتامبر - 2018
سلام ادمین دیگه از این بیماری عاجز شدم اگه ازون درمانی جواب میده پیگیری کنم هزینش که زیاد نمیشه اخه من وضع مالی خوبی ندارم
میلاد
تاریخ : 1 - می - 2018
سلام خسته نباشید
ممنون بابت سایت خوبتون
من درماتیت سبوریک دارم چندساله خواستم بدونم داروی جدید یا همیشگی واسش نیومده
ایا این ازون تراپی واسه درماتیت جواب میده؟
ممنونم
admin
تاریخ : 5 - می - 2018
سلام با روش های مختلف میتوان درماتیت سبورئیک را بهبود داد یا کاملا برطرف کرد، اما روش درمان قطعی و دائمی برای این عارضه وجود ندارد و ممکن است با قطع درمان، درماتیت سبورئیک دوباره بازگردد. ازون تراپی هم می تواند نقش کنترلی داشته باشد. عوامل تسریع کننده شعله وری بیماری شامل استرس، خستگی و تغییرات آب و هوا ( به ویژه فصل بهار و زمستان ) هستند.
سام
تاریخ : 16 - ژانویه - 2018
سلام من ترس از دارو هاي انتي بادي دارم و به اداليموماب جواب نداد بدنم
هيدرادنيت چركي دارم و درمانش با پسيورازيس يكي هست
خواستم بدونم روش ازون درماني روي بيماري هيدادنيت چركي ((پوستي)) جواب ميده لطفاً هرچه سريع تر جواب بدين ممنون
admin
تاریخ : 18 - ژانویه - 2018
سلام بله قطعا می تواند نتیجه گذار باشد.
نسيم
تاریخ : 13 - ژانویه - 2018
سلام خسته نباشيد ، واقعا اوزون درماني جواب داده ؟
اگه جواب داده مامانم رو بيارم كه زودتر خوب بشه ،
فقط كسي از هزينه هاي اوزون اطلاعي داره ؟
admin
تاریخ : 14 - ژانویه - 2018
سلام وقت بخیر با مرکز اکسیژن درمانی ایران جهت مشاوره تماس بگیرید ۰۲۱-۲۶۲۰۷۹۳۷
محمد
تاریخ : 2 - ژانویه - 2018
سلام باران خانم ایا ازون تراپی نتیجه بخش بود؟اگر جواب مثبت میشه هزینه وادرس مطب را اطلاع رسانی کنید ممنون میشم
باران
تاریخ : 28 - نوامبر - 2017
سلام
من تو کانال سایت درمانی پسوریازیس با مرکز اوزون تراپی آشنا شدم
دیروز جلسه دومی بود که رفتم دکتر تارات بهم گفتند با انجام ۱۲ جلسه اوزون تراپی یک روز در میان، پلاکها کاملا پاک شده و حتی سالهای این بیماری به صورت خاموش باقی می ماند. من تمام راه ها رو امتحان کردم و الان هم دارم اوزون تراپی رو تست میکنم امیدوارم جواب بده . با آرزوی سلامتی برای همه دوستان
اگه جواب گرفتم حتما اینجا پیغام میذارم براتون
احمد
تاریخ : 20 - نوامبر - 2017
با سلام . ممنون میشم اگه ادمین بزرگوار اطلاعاتی در مورد بهبود یافتگان با اوزون رو در اختیار بگذارند یا عزیزانی که با این درمان معالجه شدند نظرشون رو بدن . سپاس فراوان
فرزین
تاریخ : 11 - نوامبر - 2017
سلام
میخواستم بدونم که آیا تا به الان کسی در ایران از این روش استفاده کرده،اگر میشه لطفا اطلاعاتش رو دراختیار دیگران قرار بدهید. با سپاس
شیرزاد
تاریخ : 8 - نوامبر - 2017
سلام ادمین گرامی
آیا ازون تراپی برای آرتریت پسوریازیس هم مفید هستش؟
admin
تاریخ : 8 - نوامبر - 2017
سلام بله طبق دستورالعمل های آن آرتریت هم یکی از بیماری هایی است که استفاده اوزون درمانی برای آن تایید شده است.
یعقوب
تاریخ : 1 - نوامبر - 2017
سلام
بعد هر دوره اوزون درمانی تا چه مدت پوست پاک هستش و خبری از علایم پسو نیستش
admin
تاریخ : 2 - نوامبر - 2017
سلام در صورت مراقبت های فردی از عوامل تشدید پسوریازیس درمان با اوزون موثر و استمرار دارد.
امید
تاریخ : 31 - اکتبر - 2017
سلام وتشکر بخاطر مطالب مفیدی که درسآیت قرار میدید این روش اوزون درمانی واقعا بدون بازگشته شما چقد به این اوزون درمانی واسه بیماران امیدوار به درمان کامل هستید؟؟؟
admin
تاریخ : 1 - نوامبر - 2017
سلام وقت بخیر خوبی های درمان با اوزون یکی اینکه عوارضی ندارد دوم اینکه کاملا طبیعی است سوم اینکه جدیدترین روش درمانی است چهارم اینکه درمان با اوزون باعث بهبود عملکرد کلی بدن می شود. بله یکی از بیماری هایی که توسط اوزون درمان می شود و از سوی fda تایید شده اوزون درمانی است. که می تواند یکی از گزینه های درمان علائم پسوریازیس باشد.